Rencontre avec Dirk Drasdo et William Weens de l’équipe-projet Bang qui mène des recherches sur ce sujet.
Quelles sont les recherches menées dans ce domaine par votre équipe ?

Dirk Drasdo et Wiliam Weens : Notre groupe travaille sur divers projets et plus globalement sur l’organisation des tissus, leur régénération ainsi que sur les processus de croissance des cellules dans les cancers du foie et du poumon.
Jusqu’en 2011 nous étions impliqué dans le projet CancerSys. Ce dernier était un projet de l’UE traitant des premières étapes du développement du cancer du foie. Les expérimentateurs et expérimentatrices travaillaient en collaboration étroite avec nous, dans le but d’expliquer les phénotypes des tumeurs observées dans les expériences. Dans ces dernières, une molécule était injectée dans des souris transgéniques afin d’induire la formation de tumeurs.
Nous travaillons aussi sur des projets similaires dans le cancer du poumon afin d’évaluer la croissance et les propriétés d’invasion du carcinome du poumon à petites cellules, un cancer très agressif. L’objectif est d’étudier les options thérapeutiques telles que les effets de la chimiothérapie et de l’érythropoïétine (protéine portant un glucide) à l’aide de modèle et d’expériences. Les expérimentations et la modélisation sont réalisées en incluant les processus présents à différentes échelles – intracellulaire, cellulaire et multicellulaire – et en considérant les différents systèmes expérimentaux : in vitro, murin et humain. Les modèles mathématiques sont utilisés pour guider la stratégie expérimentale dans la direction des expériences les plus prometteuses et instructives.

D’autres projets sur lesquels nous travaillons abordent l’homéostasie* dans des tissus afin de comprendre les mécanismes sous-jacents au contrôle de la taille des populations de cellules ; les effets des contraintes biomécaniques sur la croissance des sphéroïdes de tumeurs ; l’effet de certains médicaments sur les cellules du foie in vitro pour estimer le remplacement à long terme des modèles in vivo (animal) par des systèmes in vitro.
Enfin, nous sommes actuellement associés au projet sur le foie virtuel (virtual liver network : VLN), voir ci-dessous.
Chaque projet est financé par des organisations nationales en France, en Allemagne ou par l’UE. Tous les projets sont menés en collaboration rapprochée avec des partenaires (expérimentateurs, modélisateurs, industriels). Ceci permet de directement paramétrer les modèles grâce à des données expérimentales, de valider les prédictions des modèles aussi bien que d’inclure de la modélisation de pointe à chaque échelle. Enfin, cela pousse dans la direction d’une recherche donnant une valeur ajoutée aux entreprises.
En quoi les sciences informatiques et les mathématiques sont-elles utiles dans ce type de recherche?
Dirk Drasdo et Wiliam Weens :
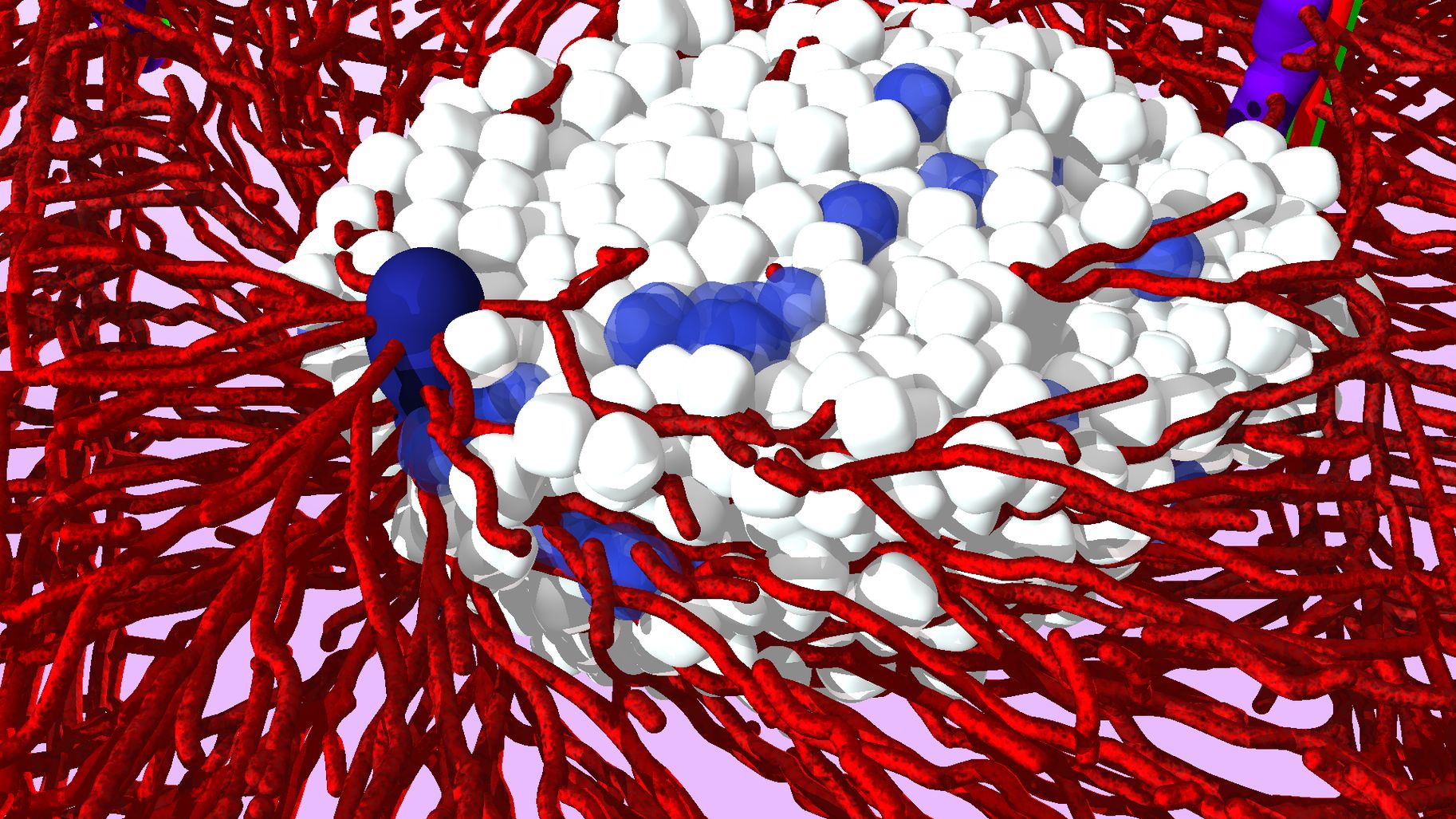
Les méthodes que nous utilisons pour analyser l’origine de l’organisation multicellulaire combinent l’informatique, les mathématiques et la physique utilisant largement une chaîne de processus développée dans notre groupe pour comprendre les mécanismes d’organisation des tissus au niveau histologique (étude de tissus biologiques). La chaîne de processus est bien illustrée en regardant la régénération du foie après une injection toxique et destructrice.
Pour construire des simulations réalistes, l’architecture du foie a été déterminée au niveau histologique à partir d’image de microscopie optique et confocale obtenues pendant toute la phase d’injection. Ces images ont été analysées et ont permis de mesurer les paramètres de l’architecture et des dommages dans les lobules ce qui a permis ensuite d’obtenir un échantillon statistique représentatif quantifiant le foie avant et après l’injection et ses dommages associés.
Les résultats obtenus ont été utilisés pour construire l’état initial de notre modèle mathématique et le configurer pour la régénération dynamique. Dans ce modèle, les vaisseaux sanguins et les hépatocytes (des cellules présentes uniquement dans le foie) sont représentés.
Les simulations de modèle peuvent être vues comme des « expériences sur ordinateur », ce sont des expériences virtuelles. Les résultats produits avec notre modèle sont comparés quantitativement avec des résultats expérimentaux. Grâce à une stratégie d’analyse de sensibilité, en variant chaque paramètre mathématique dans un domaine physiologiquement raisonnable et en modifiant le modèle grâce à de nombreux échanges avec nos partenaires expérimentateurs, nous avons pu finalement prévoir un processus, inconnu et validé par la suite, de la régénération du foie.
Notre ligne de recherche actuelle suit ce schéma général : définition des paramètres spatiaux à partir d’images expérimentales, construction du modèle, comparaison des résultats avec des données expérimentales. Le traitement et l’analyse d’image, suivis de la définition des paramètres des images analysées peuvent permettre à un ou une spécialiste – par des estimations indépendantes de matériel histologique, d’objectiver son diagnostic. Comme nous travaillons la plupart du temps à l’échelle histologique, nous utilisons principalement les modèles à base d’agents dans lesquels chaque cellule est représentée. Ce type de modèle comprend deux principaux types :
- des modèles où chaque cellule est caractérisée par des propriétés physiques et cinétiques dans un espace continu. En effet, une cellule se déplace à cause des forces qui lui sont appliquées ainsi que son déplacement propre (sa micromotilité). Les cellules peuvent croître, se diviser, mourir, changer leur polarité, etc. et ainsi accomplir tous les changements d’état et les activités observés dans les expériences.
- des modèles à base de règles sur des réseaux non structurés calibrés par le modèle physique décrit précédemment afin d’éviter tout artefact causé par un choix inapproprié des règles. Ce dernier type permet de travailler sur des populations de plus grande taille pour certains modèles jusqu’à un milliard de cellules mais – comme cela se passe dans un espace discret – sans autoriser les changements graduels dans la position de la cellule. Pour cette raison, nous complétons de plus en plus nos méthodes par des modèles continus où les équations sur les cellules ne sont pas résolues individuellement mais remplacées par des variables de densités locales.
L’avantage fondamental des modèles individu-centrés basés sur les cellules est que le réseau intracellulaire de signalisation moléculaire ainsi que les réseaux métaboliques (considérablement étudiés dans la biologie des systèmes depuis une dizaine d’année), peuvent être directement et littéralement intégrés dans chaque cellule et couplés à l’état de la cellule et de son activité. L’évolution des nutriments et signaux dans l’espace extracellulaire est calculée à l’aide d’équations aux dérivées partielles.
Jusqu'en octobre 2011 vous faisiez partie du projet Cancersys , depuis vous faites partie du projet Virtual liver. Quel est votre rôle et quels en sont les enjeux ?
Dirk Drasdo et Wiliam Weens : En effet, nous faisons partie du Virtual liver network, probablement le plus grand réseau sur la biologie des systèmes qui concentre mondialement ses efforts sur un objectif commun. Le réseau s’étend sur toute l’Allemagne et nous sommes le seul partenaire étranger. Il inclut 69 cheffes et chefs de sous-projets dans différents instituts de recherche et universités ainsi que dans l’entreprise Bayer. Ce grand défi scientifique vise la mesure et la modélisation de tous les processus à toutes les échelles spatiales et temporelles du foie sain et malade. Ceci inclut la régulation de l’expression des gènes, la transduction du signal intracellulaire, le métabolisme, les signaux intercellulaires, les cellules de types différents et dans différents états, les unités fonctionnelles de l’organe telles que les lobules (la plus petite sous-unité fonctionnelle du foie), les lobes du foie en incluant les réseaux sanguins et biliaires, enfin l’organe dans son ensemble et l’impact à l’échelle du patient ou de la patiente.
Les processus de chaque échelle doivent être liés de façon pertinente au processus et à l’état des échelles plus petites et plus grandes qui sont consécutives mais pas seulement. Cela implique de sérieux défis dans le développement des modèles à chaque échelle, de leurs intégration et l’implémentation logicielle pour aboutir à un modèle intégré liant tous les différents composants.
Le second grand enjeu est dans l’organisation de la communication et du déroulement des opérations qui doivent être horizontales entre les expérimentateurs/trices et modélisateurs/trices travaillant à une certaine échelle et verticale pour ceux travaillant à différentes échelles. Comme les méthodes expérimentales et les méthodes de modélisations sont souvent différentes entre les différentes échelles, la communication à l’interface de chacune est une tâche ambitieuse. Une équipe de gestion et un comité consultatif scientifique doivent être établis pour coordonner et guider les activités des partenaires, permettant alors au réseau de progresser comme un collectif bien orchestré.
Dans ce projet, nous sommes chargés de la modélisation intégrée à l’échelle du lobule et du lobe, échelle dont nous sommes référents au niveau administratif dans l’équipe de gestion.